2018年欧美及中国儿科用药行业政策汇总 加大儿科药物研发支持,鼓励申报儿科用药
以美国为代表的发达国家通过立法逐步建立了较为完善的儿童用药管理制度,欧美国家的儿科药物立法及政策对我国儿科药物政策的发布有一定的借鉴作用。我国儿科药物的政策立法起步较晚,2014年《关于保障儿童用药的若干意见》,是我国几十年来首部关于儿童用药的综合性指导文件,之后为落实《意见》中相关措施,不断出台多项有关儿童药物的政策,推动了我国儿科药物行业健康快速发展。2016-2019年,三部委发布三批共计108种儿科药品种,充分彰显了三部委鼓励研发申报儿童药品的决心和力度,也使我国儿科用药行业发展目标更加具体化。
欧美国家为儿科用药政策先行者,政策出台鼓励儿科用药研发
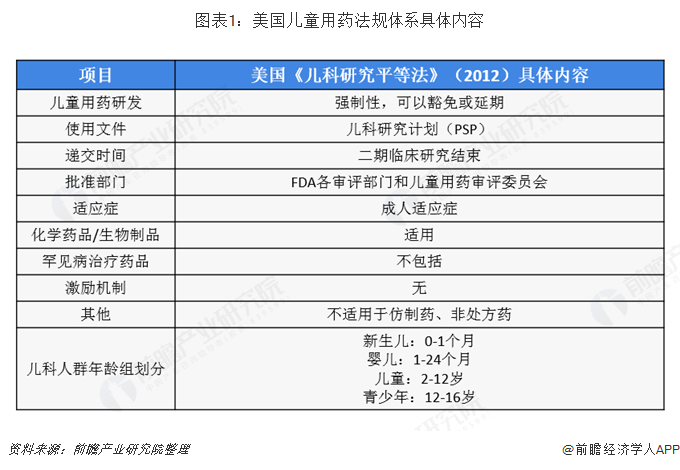
以美国为代表的发达国家通过立法逐步建立了较为完善的儿童用药管理制度。发达国家对儿童新药的开发、儿童临床试验的管理、儿童药品的信息提供均从保护儿童权益的角度进行了规定,强制性要求制药企业对每一种可能发展为儿童用药的新药必须提供该药的儿科研究数据。同时也对制药企业进行儿童新药开发提供了包括资金、税收、快速评审、市场垄断权和研究资助等诸多方面的优惠措施。美国为了获取更多的数据支持儿童用药,促成了两个互补的法律问世,即《儿科研究平等法》(PREA)和《最佳儿童药品法》(BPCA)。
目前,美国儿科用药的两部法律根据2012年的《FDA安全与创新法》被授权长期有效,根据2012年前的PREA,未要求企业在新药研制中递交儿童用药研究计划和时间表,2012年7月之后,根据《FDA安全与创新法》的相关条款,研究者应当在新药研制的早期阶段就递交儿童用药的初期研究计划,目的是在研制成人用新药的同时,尽早考虑未来能否适用于儿童,并根据计划开展与研制同步的儿童用药试验。FDA在2016年3月颁布《儿童用药研究计划:儿童用药初期研究计划及后续修订计划的内容和程序》作为指南草案公开征求意见,并且计划颁布与《FDA安全与创新法》有关条款相衔接的法规。
欧盟针对儿科用药的法律为2007年1月27日设立的《儿科药品管理条例》(ThePediatricRegulation,PR),根据该条例,自2008年7月26日起,所有新药申请必须提交儿童药物研发计划(pediatricinvestigationplan,PIP),自2009年1月26日起,新适应症、新处方、新剂型的补充申请也必须包括儿童用药研制计划。
PIP的基本要求与美国的PSP相一致。欧盟要求申请者在成人的一期临床试验结束就递交PIP,以促使儿童药物研发计划从一开始就成为整个药物研发计划的一部分。EMA收到PIP申请后,在30天内进行审查,之后儿科委员会(pediatriccommittee,PDCO)在60d内进行审评并给出意见。整个PIP的审评批准时限是140d,如果申请者需要和PDCO进一步讨论,则最长不超过290d。PDCO关于PIP的审评意见都在网上公布。

《关于保障儿童用药的若干意见》为我国首部儿童用药综合性指导文件
相对于欧美国家针对儿童用药立法进程和强制性开发儿童用药政策而言,我国儿科用药政策和法规尚处于起步期,长期以来,我国并没有针对儿童药物进行专项政策和立法,导致我国儿童药物法规政策缺乏,企业研发儿童药物积极性减弱,导致儿童用药缺失。2014年5月,原卫计委、发改委等六部分联合印发了《关于保障儿童用药的若干意见》,是我国几十年来首部关于儿童用药的综合性指导文件,涉及儿童药研发、使用、报销的六大相关部委共同参与,不仅有宏观规划,更有具体落实措施,更加贴合儿童就医用药实际情况,利于儿童药企业对接,从而促进儿童药市场扩容。
通过加快申报审评,促进研发创制的举措鼓励制药企业加大对儿童用药的研发投入和研发热情;对儿童用药价格给予专项支持,扩大儿童制药企业的利润空间,建立保障预警机制和指导体系,对儿童用药生产供应进行保障;完善体系建设,提高临床使用综合评价能力,完善用药指南、加强药品说明书管理、开展临床使用综合评价、完善儿科药物人才体系建设等。

注重儿童药物的用药安全,规范处方行为,发挥药师作用;大力推进儿科用药中成药发展,发挥传统中医药优势;加强合理用药宣传,有关部门和地方积极配合,结合各地特点,细化工作措施。

儿童用药政策频发,儿科用药市场前景广阔
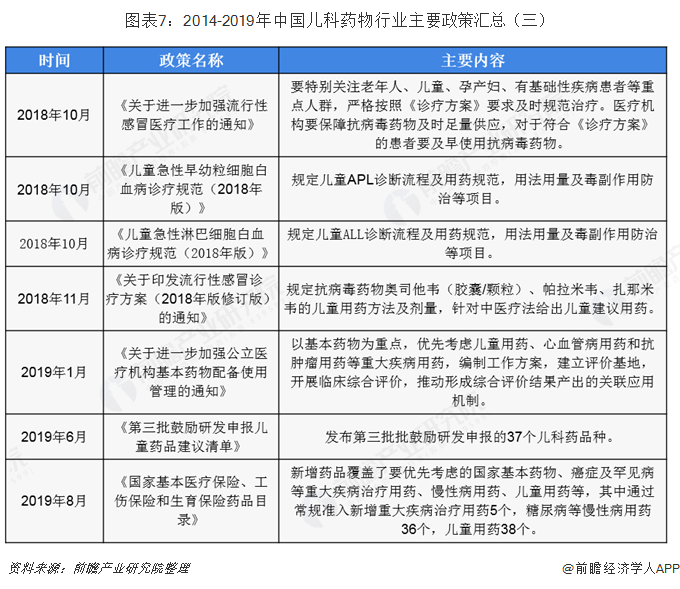
自2014年六部委《关于保障儿童用药的若干意见》印发后,为我国儿科药物发展指明了方向,后续几年中,国家频频出台政策支持儿科用药行业发展,并不断修正使得我国儿科药物行业快速健康发展。未落实《关于保障儿童用药的若干意见》中的相关要求,2016年1月,《关于临床急需儿童用药申请优先审评审批品种评定基本原则及首批优先审评品种的公告》中确定了儿童用药优先审评审批的品种;2016年3月,《儿科人群药物临床试验技术指导原则》为儿科用药临床试验实施提供指南;2016-2019年,期间卫计委、工信部和食药监局推出3批鼓励研发申报儿童药品清单共计108种,极大的丰富了儿科用药品类。


三批清单涵盖108种类,三部委鼓励研发申报儿童药品
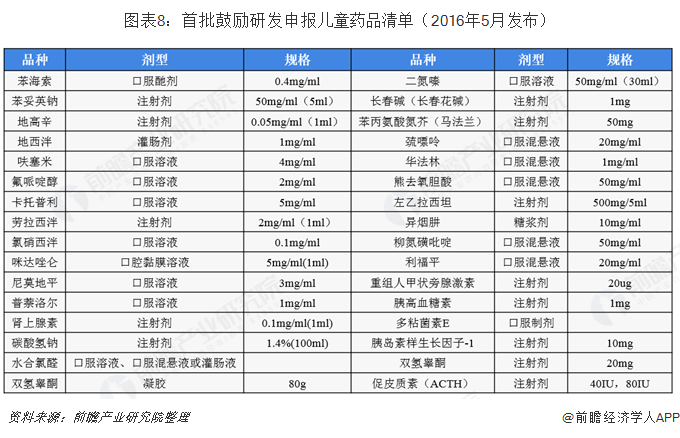
我国儿科药物行业近来来最大的政策激励就是2016-2019年由卫计委、工信部和食药监局三部委发布的,连续三批鼓励研发申报儿童药品清单。根据中央全面深化改革领导小组办公室2016年重点改革任务分工安排,为深化医改,进一步做好保障儿童用药工作,促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,国家卫生计生委、工业和信息化部、食品药品监管总局组织专家制定了《首批鼓励研发申报儿童药品清单》,涵盖了32个儿科用药品种;2017年5月,三部委印发了《第二批鼓励研发申报儿童药品清单》,涵盖了39个儿科药品种;2019年6月,《第三批鼓励研发申报儿童药品清单》出炉,涵盖了37个儿科药品种。三批清单共涵盖了108个种类的儿科药品种,充分彰显了三部委鼓励研发申报儿童药品的决心和力度,也使我国儿科用药行业发展目标更加具体化。


以上数据及分析均来自于前瞻产业研究院《中国儿科用药行业市场前瞻与投资战略规划分析报告》
更多深度行业分析尽在【前瞻经济学人APP】,还可以与500+经济学家/资深行业研究员交流互动。
前瞻产业研究院 - 深度报告 REPORTS
本报告主要从儿科用药各细分市场的角度来对进行阐述与分析,详尽地分析了儿科用药细分市场的发展概况、药品竞争格局、企业地位竞争等;并深入的介绍了各类药物中主要产品...
如在招股说明书、公司年度报告中引用本篇文章数据,请联系前瞻产业研究院,联系电话:400-068-7188。
品牌、内容合作请点这里:寻求合作 ››

前瞻经济学人
专注于中国各行业市场分析、未来发展趋势等。扫一扫立即关注。





























