Cell:张元豪团队开发ENTER系统,破译细胞间通讯,助力疫苗开发和癌症免疫治疗

(图片来源:摄图网)
作者|nagashi 来源|生物世界(ID:ibioworld)
在通讯技术高度发达的互联网时代,手机、电脑等电子产品让人与人之间的沟通交流变得便捷简单,我们只需要动动手指头,便能通过各种社交软件把心中所想倾述给远在天边的亲人朋友。
而在人体的微观细胞层面,细胞与细胞之间也有一种特殊的通讯工具——配体与受体的相互作用,它们通过这种通讯方式进行信息交流,并调节机体的各种生理活动。因此,如果我们能破译并操控这种细胞间通讯方式,就能控制细胞做出相应的反应。
近日,斯坦福大学张元豪团队(余冰菲博士和施泉铭博士为第一作者)在 Cell 期刊发表题为:Engineered cell entry links receptor biology with single-cell genomics 的研究论文。
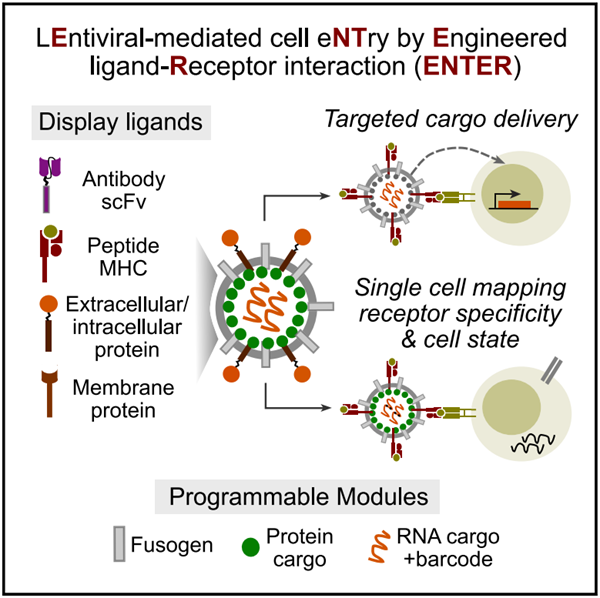
该研究描述了通过工程化受体-配体相互作用(ENTER)来显示配体蛋白、递送有效载荷和记录受体特异性的慢病毒介导的细胞侵入。ENTER技术能够系统地发现受体特异性、与细胞命运的联系以及抗原特异性货物递送,为疫苗开发或癌症免疫治疗的合理设计提供依据。

单细胞基因组学的进展为破译生物系统的分子和细胞异质性提供了前所未有的见解。尽管在破译基因表达的中心法则方面取得了实质性进展,但细胞外源性信息,如细胞间配体-受体相互作用,在单细胞水平上的研究却很少。
细胞之间通过配体-受体相互作用进行交流。例如,T细胞表面的T细胞受体(TCRs)可以识别抗原提呈细胞(APCs)表面的肽主组织相容性复合体(pMHC)并与之相互作用,从而激发免疫反应。T细胞受体(TCRs)和B细胞受体(BCRs)基因经过体细胞重组,形成不同的基因库,从而识别无数抗原。
目前已经开发了许多方法来解释TCR的抗原特异性,包括:1)使用人工APCs的细胞报告试验;2)酵母展示平台;3)基于T细胞的试验;4)DNA条形码的pMHC四聚体。尽管每种技术都有其独特的优势,但在临床样本中快速筛选pMHCs作为原代T细胞,并以高通量方式同时捕获单个T细胞的抗原图谱、TCR库和转录组仍然具有挑战性。此外,以抗原特异性方式靶向T和B细胞以选择性地改变其行为也十分具有挑战性。
值得注意的是,最近一项研究显示,pMHC假型病毒允许对抗原特异性T细胞进行基因修饰。然而,目前仍缺乏除T细胞外选择性操作抗原特异性B细胞的技术。
研究模式图
因此,在这项Cell 研究中,张元豪团队开发了一种名为ENTER的新技术,它由慢病毒介导,并通过工程受体-配体相互作用(ENTER)来显示配体蛋白、传递有效载荷和记录受体特异性。

ENTER技术是一种通过细胞进入记录配体-受体相互作用的研究平台
研究团队不断优化ENTER,以解码T细胞受体(TCR)-MHC肽、抗体-抗原和其他受体-配体对之间的相互作用。此外,慢病毒呈递策略允许ENTER捕获B细胞受体与任何抗原之间的相互作用。

优化ENTER,在病毒表面呈现细胞内抗原,解码BCR与抗原之间的相互作用
在研究团队的特殊设计下,ENTER技术可以向抗原特异性T或B细胞递送遗传载荷,从而选择性地调节混合人群的细胞行为。不仅如此,通过RNA测序获得的单细胞ENTER读数(ENTER-seq)可以实现抗原特异性、TCR克隆性、细胞类型和单个T细胞状态的多重枚举。

ENTER-seq用于大规模平行测量抗原肽序列、TCR序列和转录组
在实践应用上,CMV血清阳性患者血液样本的ENTER-seq揭示了驱动效应记忆T细胞分化的病毒表位,以及针对同一表位的克隆间和克隆内表型多样性。

体外扩增的CMV特异性原代T细胞的ENTER-seq
研究团队还设想了几个基于ENTER技术的转化应用:1)ENTER技术可用于筛选免疫原性抗原或精英TCRs,为疫苗开发或癌症免疫治疗的合理设计提供依据;2)ENTER技术可用于筛选靶向病毒抗原的BCR,从而促进治疗性抗体的开发;3)ENTER可将遗传载荷靶向递送到抗原特异性T和B细胞中,重新激活耗竭的抗肿瘤T细胞或用于耗竭自身反应性T或B细胞以治疗自身免疫;4)如果将ENTER技术扩展到其他受体-配体对,如G蛋白偶联受体、黏附分子或原钙黏蛋白,则可用于解决免疫系统之外的细胞间连接及其相关疾病。

张元豪,斯坦福大学教授,HHMI研究员,美国国家科学院院士,美国艺术与科学院院士
论文链接:
https://doi.org/10.1016/j.cell.2022.11.016
编者按:本文转载自微信公众号:生物世界(ID:ibioworld),作者:nagashi
品牌、内容合作请点这里:寻求合作 ››

前瞻经济学人
专注于中国各行业市场分析、未来发展趋势等。扫一扫立即关注。




























